
滴眼給藥毒性試驗2-藥物眼部暴露與安(ān)全性(xìng)評價(jià)
在上一篇滴眼給藥毒性試驗1中,咱們(men)一起了解了其目的與試驗設計,今天咱們繼續,看看這篇綜述中關於滴眼給藥的眼部暴露,以及局部和全身安全性評價的內容(róng)。
眼部暴露
滴眼給藥毒性試驗(yàn)的供(gòng)試(shì)品標準濃(nóng)度從0.001%到10%(即0.01 mg/mL至100 mg/mL)不等。滴(dī)眼液滴入眼睛後會被(bèi)淚液稀釋,並在一定程度(dù)上受到(dào)淚膜的阻滯,尤(yóu)其是對於蛋白結合率高的供試品(pǐn)。然而,眼表各組織(如結膜和角(jiǎo)膜上皮)的供試品濃(nóng)度(dù)卻非常高。
相反,房水的藥物生物利用度通常(cháng)低於(yú)10%。已有多位研究者探究了影響滴(dī)眼液吸收的(de)因素。影響眼(yǎn)滲透性的藥物化學特性包括:親水性或親脂性(xìng)、離子化或去(qù)離子化、分子量、製劑中的供試品濃度以及製劑中(zhōng)的添加劑等。藥物滴入眼睛後會分布到各個部分。其分布途徑可簡單地分(fèn)成兩種:(1)角膜途徑和(2)結膜/鞏膜途徑。
最近,有研究者從視網膜/脈絡膜給藥的角度假設存在(zài)三(sān)種途徑:
(1)(經角(jiǎo)膜)穿過玻(bō)璃體的途徑
(2)(經角膜)葡萄(táo)膜——鞏膜的途徑
(3)(經鞏膜)眼周途徑。各藥物的分布(bù)取決於其理化性質,如圖(tú)1所示。
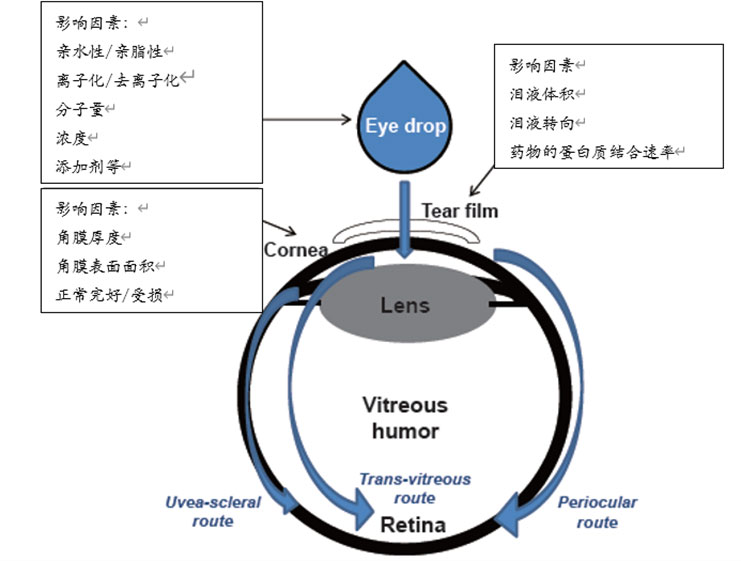
圖1 影響眼部藥物(wù)吸收的因素
動物的生理條件可能會影響眼毒性反應(yīng)。由(yóu)於(yú)藥物濃度梯(tī)度限製了藥物的吸收,角膜滲透主要取決於藥物(wù)濃度(dù)。因此,如(rú)淚液體積發生變化,無論這種變化是否與供試品有(yǒu)關(如麻醉(zuì)的影響),角(jiǎo)膜對(duì)藥物的吸(xī)收速率(lǜ)都會改變。已知眨眼會將藥物(wù)從(cóng)眼表排出,這意味著如眨眼頻率發生變化,眼部毒性反應的嚴重程(chéng)度也可(kě)能會發生變化。此外,如角膜上皮不完整(如角膜損傷),親(qīn)水性藥物更容易進入(rù)眼內。這表明,一旦角膜上皮受損,眼部供試品(pǐn)的暴露水平將提高,毒性反(fǎn)應也會加重(chóng)。
最(zuì)近已有多篇關於眼內轉運蛋(dàn)白的文章發表。研究證實,角膜、虹膜(mó)-睫狀(zhuàng)體和視網膜(mó)/脈絡膜等多個組織中存在轉(zhuǎn)運蛋白。Zhang等人(2008)通過(guò)比較不同物種(家(jiā)兔、犬、食蟹猴和人類)不(bú)同眼組織中轉運蛋白基因表(biǎo)達水平的差異,發現人眼組織中(zhōng)的主要外排轉運蛋白(bái)是多藥耐藥相關蛋白1(MRP1),主要的攝取轉運蛋白是(shì)肽(tài)轉運蛋白1(PEPT1),以及有(yǒu)機陽離子轉運蛋白1(OCT1)、有機陽(yáng)離子轉運蛋白新型1(OCTN1)和有機陽離子轉運體新型2(OCTN2)。轉運蛋白對(duì)藥物的眼部藥代動力學和物種間(jiān)特異性的影響有(yǒu)待進一步研究。
在眼睛(jīng)滴入供試品後,眼後節的暴露水平遠低於眼前節。這是因為視網膜上,尤其是(shì)視(shì)網膜後(hòu)部,存在多個解剖和功(gōng)能結構,這些結構會阻礙供試品的進(jìn)入。盡管如此,某些滴眼液(如溴(xiù)莫(mò)尼(ní)定、二氟潑尼酯和地塞米鬆等)在滴眼後仍能在視網膜上發揮藥效。一項關於尼普地洛的研(yán)究表明,局部滲透的主要路徑是藥物滴入眼睛後,從後節眼周組織逐步擴散(sàn),穿過鞏膜後部到達視網膜脈絡膜後部。近年(nián)來,眼後節局部(bù)給(gěi)藥藥物遞送(sòng)係統正在研(yán)發中。在眼後節給藥藥物的研發(fā)過程中,眼(yǎn)後節的(de)安全性評估將變得更加重(chóng)要。
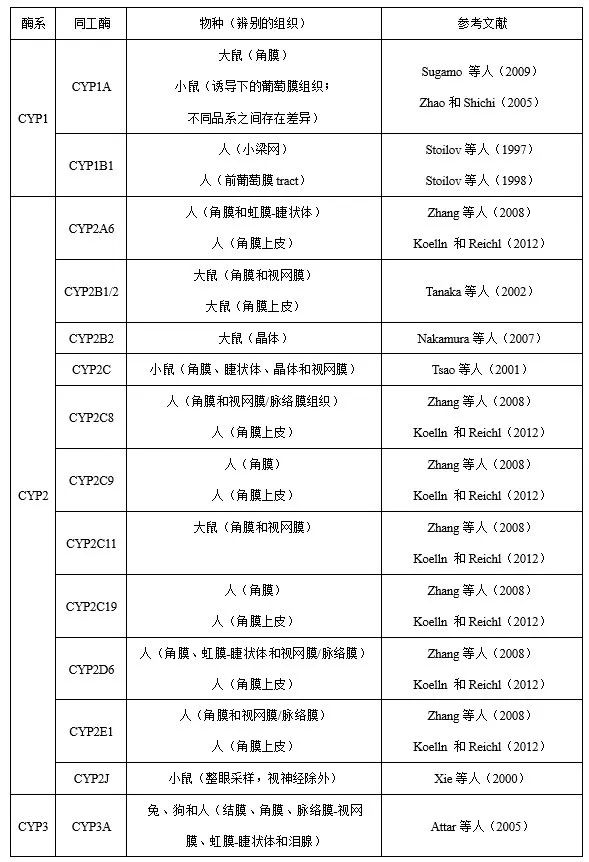
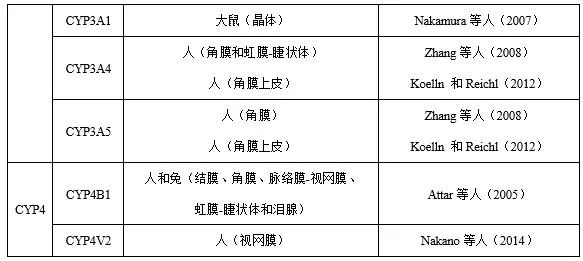
目前,已有多篇(piān)關於眼組織藥物代(dài)謝的文章發表。研究表明,眼組織中檢測到大量的(de)細胞色素P450酶(CYP),見表1。然而(ér),眼組織中這些酶的活性(xìng)或基因表達水平遠低於(yú)參與(yǔ)藥物(wù)代謝的其(qí)他器官(如肝髒(zāng))的活性或水平。關於其他藥物代謝酶,Attar等(2005、2013)引(yǐn)入了(le)氧化還原酶(如醛氧化酶、酮還原酶(méi)、環(huán)氧化酶、單胺氧化酶)、水解酶(méi)(如氨肽酶、乙(yǐ)酰膽堿(jiǎn)酯酶、丁酰膽堿(jiǎn)酯酶、羧化酯酶、磷酸酶、芳基磺化酶、N-乙酰-β-氨基葡萄糖苷(gān)酶、β-葡萄糖醛酸酶)和結合酶(如(rú)芳(fāng)胺乙酰轉移酶和穀胱甘肽S-轉移酶)。其中(zhōng)部分酶參與(yǔ)局部(bù)給藥的藥物代謝。然而,關於不同物種及不同(tóng)眼組織中酶的差異,相關資料仍然很少。
表1 眼組織細胞色素P450酶係
與黑色素的親和性是影響眼(yǎn)內藥物毒理(lǐ)特征的另一重要因素(sù)。有研究者報告稱,有色素動物的藥效比白化動物的藥效更輕微。如藥物與黑色素結(jié)合,黑色素的(de)含量可能會降低靶位點的自由藥物濃度,從而導致藥效減弱。反過來,藥物與黑色素結合後可能(néng)會蓄積,然後逐漸釋放,從而延長藥效(xiào)(即使是在(zài)停藥後(hòu))。Leblanc等人(1998)認(rèn)為,藥物本身與黑色素(sù)結(jié)合並不會影響(xiǎng)眼(yǎn)部毒性反(fǎn)應。因此(cǐ),能與黑色素結合的藥物的眼(yǎn)部毒性特征取決於藥物的毒性、與黑色素的結合方式和接(jiē)觸時間(jiān)(包括停藥期(qī))。
眼(yǎn)毒性和安全性評估
對於滴眼液(yè)製劑(jì)形式的供試品,其毒性(xìng)可分為原(yuán)發性毒性、脫靶毒性和化學品相(xiàng)關效應。由於局部給藥位點處的供試品濃(nóng)度較高,毒性反應主要發生在眼前節。因此,毒性反應最常見於角膜、結膜(mó)、虹(hóng)膜(mó)和眼周組織/器官(如眼瞼、皮膚和淚腺)。實際上(shàng),隨著多款眼表滴眼液的上市,已有多起不(bú)良(liáng)事件被報道。
角膜、結膜和眼瞼
基於預試驗(如體外細胞毒(dú)性試驗),從諸多細胞(bāo)毒性較弱的供試品中選出適合的供試品,開展滴眼(yǎn)給藥毒性試驗,以支持臨床試驗。此外,供試品的製劑也會(huì)根據臨床人體試驗所用製劑進行調整。因(yīn)此,預計在滴眼給藥毒性試驗中不會出現化學燒傷或化學腐蝕等明顯的(de)毒性反應。
充血是OITSs和臨床局部給藥中常見(jiàn)的反(fǎn)應。如供試品(pǐn)具有(yǒu)擴張血管的效果,充血通常是暫時的,且不(bú)伴隨組織病理(lǐ)學變化。然而,如充血(xuè)是由組織損傷引起,則可伴隨水(shuǐ)腫和炎症(zhèng)。
角膜混濁在(zài)毒理(lǐ)學上具有重要意義,因其會幹擾視力。因此,試驗應設置恢複期,以探究角膜混濁的可逆性。角膜混濁的可逆性可(kě)因受損(sǔn)位置(zhì)而有所不同。由於兔和人(rén)類的角膜上皮細胞在一(yī)周內能再(zài)生,如損傷區域僅限於角膜上皮和角(jiǎo)膜中心,角膜混濁很可能(néng)會消失(shī)。相反,如角膜上皮的幹細胞(如角膜緣)受損,角膜混濁可能難以複原。
由(yóu)於角膜內皮在維持角膜(mó)內部液體平衡中發揮重要作用,因此角膜內皮損傷後,常發生基質水(shuǐ)腫。角膜(mó)基質出現(xiàn)水腫、細胞浸潤以及供試品或礦物質元素沉積,都(dōu)可能導致角膜(mó)混濁。兔(tù)的角膜上皮具有再(zài)生能力,但成年靈長類動物或犬的(de)角膜內皮(pí)卻沒有這種再生能力。因此(cǐ),應認真評估兔角膜內皮的可逆性,並(bìng)探究其與人類(lèi)角膜上皮可逆性(xìng)的相關性。無論如何,一旦基質受損,由於基質重塑速度(dù)緩慢,角膜透明度的恢複時間會(huì)相對(duì)較(jiào)長。在(zài)這種情(qíng)況下,纖維組織(zhī)可能會修複基質損傷,但(dàn)角(jiǎo)膜透明(míng)度可能無法(fǎ)完全恢複。
滴(dī)眼液(yè)通常會標明與過敏相關的注意事項。然而(ér),判斷滴眼給藥毒性試驗中眼表炎(yán)症是(shì)否與過敏相關通常非(fēi)常困難(nán)。可以利用其他非臨床手段評估致敏風險,如小鼠局部淋(lín)巴結試驗(OECD,2010)。
已知口服陽離子兩親性藥物會引起動物和人類角膜磷脂沉積。Bockhardt等人(1978)報告了胺碘酮脂滴眼誘(yòu)導大鼠(shǔ)類脂沉積。有研究者證實,給予兔滴眼液會導致角膜磷脂沉積(jī)。如(rú)果磷脂沉積與角膜混濁無(wú)關,且(qiě)一直在組織病理學評估範圍內,那麽此鏡檢發現的毒理學意義可能不大。胺碘酮誘導的人體(tǐ)角膜磷脂沉積是可逆的,且對視力的損害很小。
淚液(yè)分泌減少會導致幹眼症。已知幾種滴眼液會引起淚液係統功能失調。因此,在評估角膜毒性反應時,應考(kǎo)慮淚(lèi)膜的完整性。
葡萄膜
眼壓會受到原發性藥理作用(如青光眼治療藥物)、脫靶性藥(yào)理作用、炎症引起的組織功能紊亂或損傷的(de)影響。眼(yǎn)壓持續升高可能會導致(zhì)青光眼,進而引發功能性眼損傷,甚至視力損(sǔn)傷。
藥物的原發性或脫靶性藥理作用能引起散瞳或縮瞳,但這些效應通常是暫時的。散瞳或限製瞳孔收縮的藥物(wù)會導致前房變淺和房角變窄,這些結構性變化可能會導致眼壓升高。有研究者報告稱,皮質類固醇會誘(yòu)導人類眼壓升高,但這種現象在動物身上並未重(chóng)現。
某些滴眼液會導致(zhì)虹膜(mó)變色。有研究者報告稱,治療青光眼的β阻斷劑左布諾洛爾(ěr)會引起人類(lèi)虹膜褪色。Schafer和Render(2013a)認為,炎症可能會導致(zhì)葡萄膜褪(tuì)色。另一方麵,類前列腺(xiàn)素會促進黑色素合(hé)成,導致虹膜色素沉著。在患者身上,這種色素沉著通常是永久性的。
晶狀體
晶狀體的前端正對著眼房,眼房內(nèi)充盈著房水。這種結構使晶狀(zhuàng)體上皮能直接接觸到眼房內的藥物。有研究者報(bào)告稱,人類晶狀體混濁可能是藥物局部應用引起的,例如抗膽(dǎn)堿酯酶、毛(máo)果(guǒ)芸香堿和乙酰膽堿。在動物實驗中,發現晶狀體(tǐ)混濁(zhuó)是由多重機製引發的,包括糖、蛋白質、脂質和電解(jiě)質代謝異(yì)常。人(rén)類和(hé)動物(wù)的部分晶狀體混(hún)濁是暫時性的,但(dàn)受損晶狀體組織的修複速度非常緩慢。Schafer 和 Render(2013b)認為,糖皮質激素誘導的人類白(bái)內障難以在動物模型中複(fù)現。
視網膜(mó)
許多藥物和化學品可引(yǐn)起各種形式的視網膜毒性。如藥物通過係統給藥,視網膜毒性在非臨床試驗和(hé)臨床試驗中都較為常見;而局部給(gěi)藥則較少出(chū)現毒性反應。這(zhè)很可能是由於局(jú)部給藥時藥物的生物利用度(dù)較低,尤其(qí)是(shì)眼後節,包(bāo)括視網膜在內的生物利用度更(gèng)低。然而,如上(shàng)所述,有報告稱(chēng)某(mǒu)些滴眼液在眼後(hòu)節也能發(fā)揮藥理作用。因此,對視網膜進行OITSs眼科檢查變得尤為重(chóng)要,包括使用成像(xiàng)技術(shù)檢測輕微的視網膜變化。
特異質(zhì)藥(yào)物不(bú)良反應
特異質藥(yào)物不良(liáng)反應(IDRs)被認為是可能致命的人體副作用,主要影響皮膚、肝髒(zāng)和骨髓。有研究人員認為(wéi)這些反應是由免疫介導的。根據George等人(2014)的表述,局(jú)部給藥(yào)時出現Stevens-Johnson綜合征(zhēng)(SJS)和(hé)中毒性表皮壞(huài)死鬆解症(TEN)的情況非常(cháng)罕見。然而,已有案例報告顯(xiǎn)示,多佐胺/噻嗎洛(luò)爾/拉坦前列素滴(dī)眼液可引起TEN(弗洛雷斯等人,2005),而磺胺甲惡唑滴眼液則可引發Stevens-Johnson綜合征。因此(cǐ),在未(wèi)來的非臨床試(shì)驗中,應考慮對特異質藥物不良反應進行安全性評估。
局(jú)部和係統未觀察到有害作用水平
在滴眼給藥的毒性試驗中,局部和(hé)係統未觀察到有(yǒu)害作用(yòng)水平應分別定義。Lewis等人(2002)建(jiàn)議,在局部給藥試驗中,應建立兩種未觀(guān)察到有害作用水平:一(yī)種基於局部(給藥部位)藥效,另一種基於係統藥效。OITSs的局部毒(dú)性反應和係統毒性反應通常不會相互影響。然而,如果動物狀況不(bú)佳,係統毒性可能會影響眼科檢查結果。
計算機模擬預(yù)測眼部暴露(lù)量(liàng)和(hé)眼毒性風險評估
測量人(rén)體眼組織(zhī)的藥物(wù)暴(bào)露水平是不現實的。即(jí)使能測量實驗動物眼組織的藥代動力學參數,也需要大量動物才能進行全麵分析。計(jì)算機模擬的最新進展或許能夠解決這一困境。例如,Tojo(2004)建立了眼部給藥的藥代動力學模(mó)型。有研究者(zhě)報告使用計算機(jī)模(mó)擬了兔子滴眼給藥後(hòu)眼前節組(zǔ)織的藥物滲(shèn)透情況。此外,Ueda等人(2010)建立了正常眼(yǎn)和患病眼中抗菌藥物的眼部擴散模型。這些模擬(nǐ)模型和計算機(jī)預測有助於(yú)估算人體和動物的眼部暴露量,並為未來技術發展提供了挑戰和機遇。
滴眼給(gěi)藥毒性試驗的係統毒性
全身器官檢查OITSs的係統毒性評估與通過係統給藥的一般(bān)毒性試驗的(de)係統毒性評估基本一致。Weir和Wilson(2013)總結(jié)了眼毒性試驗的係統終點,具體檢查項(xiàng)目包括:臨床觀察、體重、攝食、臨床病理、剖檢、髒器稱重、組織(zhī)病理學、毒代動力學(TK)和免疫原性(生物學)。基於既往的知識和經驗,活體階(jiē)段的係統檢查(不包括前章所述的眼科檢查)如表2所示。其中,心電圖和血壓測(cè)量是猴和犬係統給藥的一般毒性試驗的常規檢查。由於滴眼液的副作用常見於心血管係統,因此OITSs也(yě)需要進行相關參數(shù)的檢查。
表2 滴眼給藥毒性試驗中活體(tǐ)階段的(de)係統檢查(除眼科檢查外)

與係統給藥的一般毒性試(shì)驗(yàn)類似(sì),在滴眼給藥毒性試驗中也會對全身器官進行組織病理學檢查,這(zhè)對評估全身器官的毒性具有重要意義。然而(ér),如係統給藥的單個毒性試驗已確定未觀察到有害作用水平(NOAEL),且(qiě)藥代(dài)動力學(TK)數據有(yǒu)效(xiào),那在滴眼給藥毒性試驗中對全身器官進行組織病理學(xué)檢(jiǎn)查可能意義不大。
毒性相(xiàng)關的係統暴露量的考量
與係統給(gěi)藥的藥物相比,滴眼液的係統暴露水(shuǐ)平相對(duì)較低。舉例來說,若雙眼每天滴入3次1%的滴眼液(假設每滴體積為40 µL,體(tǐ)重60 kg),可算(suàn)出劑量水平為0.04 mg/kg/day。滴眼液的係統生物利用度通常高於75%,或20%至(zhì)100%不等。相較於其眼內生物利用度,係統生物利用度相對較高。絕大部分滴眼液會流入(rù)鼻淚管並粘附在鼻黏膜上。在這個過程中,滴眼液被吸收並進入係統循環(huán)。Lee等人(1993)報告稱,至少50%的藥物(wù)通過鼻黏膜經係統吸收進入血液。因此,眼科滴眼藥物的藥代動力學與靜脈注射藥物(wù)的(de)藥代動力學相似,兩者都較少受到首過效應的影響(xiǎng)。一(yī)項使用噻嗎洛爾(ěr)的研究表明,人體靜脈注射和滴眼給藥的係統生物利用度和心肺效應相似。
毒代動(dòng)力學在評估(gū)滴眼給(gěi)藥毒性試驗的係統毒性方麵非常重要(yào)。此外,在單側滴眼給(gěi)藥時,TK數據有助於解釋對照(zhào)眼的眼科檢查結果。目前,藥物濃度檢測的生物分析(xī)技(jì)術正不(bú)斷發展,能夠檢測到10 pg/mL甚至更低(dī)的藥物濃度。這項技術的進步有助(zhù)於更準確地(dì)評估OITSs和(hé)人體臨床試驗的藥(yào)代動力學特征,從而確定係統毒性的安全邊(biān)際。
係統毒性反應和安全性評估
在滴眼液(yè)的臨床和非(fēi)臨床試驗(yàn)中,係統毒性反應和副作用都非常(cháng)罕見。青光眼治療藥物引起的係統副作(zuò)用主要影響心血管(guǎn)係統和中樞神經係(xì)統。因(yīn)為(wéi)滴眼液的劑量水(shuǐ)平(píng)並不會根據受試者(zhě)的體型而進行調整,所以(yǐ)體型較小的人群(如(rú)兒童)出現係統副作(zuò)用的風險相對較高。此前已有多起滴眼液誘導兒童產(chǎn)生係統副作用的案例,例如阿托品、環戊酮和散瞳劑。
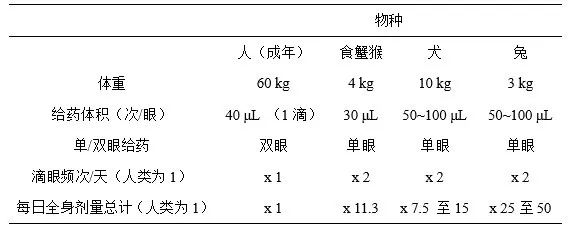
在(zài)眼(yǎn)科滴眼給藥毒性試驗(OIITSs)中,係統劑量水平/體重遠遠(yuǎn)高(gāo)於臨床試驗,這是因為所(suǒ)用的(de)猴和兔的體重約為3至(zhì)4 kg。即使所用製劑的藥物濃度相同(tóng)(表(biǎo)3),猴和兔的日(rì)用係統劑量是人體的7.5至50倍。如果提高藥物(wù)濃度或增加給(gěi)藥頻次,OIITSs的係統劑量水平將會與ICH M3指導原則(ICH, 2009)建議的最(zuì)高(gāo)劑量水平(意味著暴露量是臨床劑(jì)量的50倍)持平。因此,在某些(xiē)情況下,OIITSs適用於評估人體臨床試驗所用藥(yào)物的係統毒性反應。總體而言,如在OIITSs中增加係統毒性反應評估和係統毒代動力學(TK)評估,非臨(lín)床試驗(yàn)就無需包括單獨的係統毒性試驗。這種(zhǒng)做法符合動物倫理委員會提出的3R原則(ILAR, 2011)。然而,關於是否需開展單獨的毒性試驗以評估係統毒性反應的合理性,仍需進一步討(tǎo)論(lùn)。
表3 臨床人體試驗和滴眼給藥毒性(xìng)試(shì)驗的相對係統劑量水平
結論
本篇綜述旨在在(zài)介紹滴眼給藥毒性試驗,引起研究人員對這類特殊性試驗某些要點(diǎn)的關注。滴眼給藥毒性(xìng)試驗的特(tè)點(diǎn)之一(yī)在於眼球直接給藥(yào)。在開展此類試驗時,毒理學家(jiā)需認真設計試驗,製定安全性評(píng)價策略,將滴眼液的所有(yǒu)特征納入到考慮範圍內。


