
實驗動物非常規眼科檢查簡介
如前文《實驗動物的常(cháng)規眼科檢查》一文中所寫,眼科檢查的操作流(liú)程可因動物種屬和特點(diǎn)的研究目的而異(yì)。如果目的是篩查藥(yào)物等物(wù)質對眼部組織(zhī)的不良影響,則應至少進行間接檢眼鏡(jìng)和(hé)裂隙燈顯微鏡的檢(jiǎn)查。根據檢(jiǎn)查目的(de),也可執行其它程序,比如角膜染色(sè)、角膜知覺(jiào)檢查、角膜厚度測量、眼壓計、眼底照相、熒光血(xuè)管造(zào)影、光學相(xiàng)幹斷層(céng)掃描 (OCT, Optical Coherence Tomography) 和視覺係統的電生理評估(例如視網膜電圖、多焦視網膜(mó)電(diàn)圖、視覺誘發電位)。
許多無創性眼科診斷技術,可同時提供眼前節與眼後節的結構和功能信息。下麵(miàn)討論了其中一些技術,對這些技術適用於(yú)毒理學、眼科研究和臨床應用的場景進行了初步討論。
01、眼壓測量
眼壓計用於獲得眼(yǎn)內壓 (IOP, Intraocular Pressure) 的間接測量值。市麵上(shàng)有幾種不同的商品化的手持式設(shè)備,其便攜(xié)性足以供眼科檢查人(rén)員使用,如壓(yā)陷(xiàn)、壓平或回(huí)彈式眼壓計(jì)。對於合同研發組織(CROs, Contract research organizations)使用的多種(zhǒng)動物種屬,通常認為Schiotz壓陷式眼壓計的結果不準確、不可靠,因此不應用(yòng)於眼部毒理學研究。由於許(xǔ)多眼壓(yā)計最初設(shè)計用於人的(de)角膜,用於動物的讀數可(kě)能略不準確,但如果在整個研究(jiū)期間由同一名檢查者(zhě)使用相同的眼壓計,則研究中發生的眼壓變化將是(shì)有效的。
大多數實驗動物的 IOP 範圍為 12-25 mmHg,雙眼之間的差(chà)異應≤5 mmHg。IOP 可受到多(duō)個變量的影響,如:保定技術、動(dòng)物應激、晝夜節律眼(yǎn)位、鎮靜或麻醉、角膜厚度等。如果可能,在進行眼壓測量時,應在整個(gè)研究期間保持(chí)如下細節的統一:每天相(xiàng)同的測量時間、相同的(de)眼壓計和操作技術、同一(yī)組檢查人員和保定人員,來測量試驗(yàn)內所有動物的 IOP。應在散瞳(tóng)之前測定(dìng)眼壓。當眼(yǎn)壓測量(liàng)是研究的關鍵點(diǎn)時,建議研究開始前先對動物(wù)進行保(bǎo)定適應和操作適應。
最常使用的(de)是壓(yā)平式眼壓計,如Tono-Pen XL®、Tono-Pen Vet®、Tono-Pen AVIA® ,或非接觸式眼壓計(jì)。眼壓測量需表麵麻醉時,0.5% 丙美卡因是最常見的選擇(zé)。該技術測量壓平角膜(mó)給定區域所(suǒ)需的力,然後(hòu)將該施加力轉換為眼(yǎn)壓值(單位:mmHg)。一些壓平式眼壓計具有自我校準的優勢(圖1),而非接觸式眼壓計(jì)可提供紙質副本用於記錄保(bǎo)存,兩者都是藥物(wù)非臨床(chuáng)研究質量管(guǎn)理(lǐ)規範(GLP,Good Laboratory Practice)類研(yán)究的理想技術。Tono-Pen XL 和 Tono-Pen Vet® 產生4個獨立讀(dú)數,可對讀數(shù)取平均值,並顯示IOP和誤差百分比,即單個(gè)讀數之間變異性。Tono-Pen AVIA® 產生10 個獨立讀數,並以置信度百分比報告 IOP 和變異性。對於 Tono-Pen XL®,誤差百分(fèn)比應 <5%,而對於 Tono-Pen AVIA®,置信度百(bǎi)分比應 >95%。
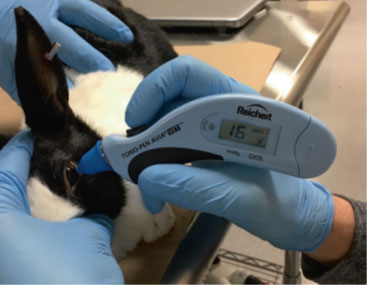
圖1 Tono-Pen AVIA Vet® 用於測量Dutch Belted Rabbit的眼壓
回彈式眼壓計通過向角(jiǎo)膜發射一個小的塑料探針頭(tóu)來(lái)確(què)定眼壓,然後探頭反彈回設備中(zhōng),產生感應電流,由此(cǐ)計算眼壓(yā)值。為了準確測(cè)量,探針必須(xū)以水平位置在角膜上擊發,即探(tàn)針與地板平行。實(shí)驗動物最常用的回彈眼壓計(jì)是(shì) Tonovet®(圖2a)。Tonovet® 專門(mén)針對犬、貓和馬進行了校(xiào)準,但也已在其它種屬中可靠地使用。TonoLab 眼壓計是專門為小鼠和大鼠(shǔ)設(shè)計和校準的(de)(圖2b)。在許(xǔ)多實驗動物中,包括犬、兔和大鼠,Tonovet 和 TonoLab 眼壓計具(jù)有不需要局部麻醉的優點,並且比 Tono-Pen® 更容易獲得 IOP,其缺點是在使(shǐ)用前不能自(zì)行(háng)校準。與 Tono-Pen® 和 Tonovet® 一樣(yàng),它也取6 個讀(dú)數的平均值,並使用眼壓值的左側欄指示誤差百分比。測量時,應沒有錯誤欄,或者欄應該位於(yú)屏幕的左下角,以使(shǐ)讀數可以接(jiē)受。
無論使用何種(zhǒng)眼壓計,通常(cháng)每(měi)隻眼應獲得並記錄至少 2-3 個最終平均讀數。由於(yú)除非接觸式外的所有眼壓計僅給出數(shù)字讀數,設備不會創建永久性記錄,因此必須手動記(jì)錄 IOP 或將其輸入(rù)計算機(jī)數據庫中。
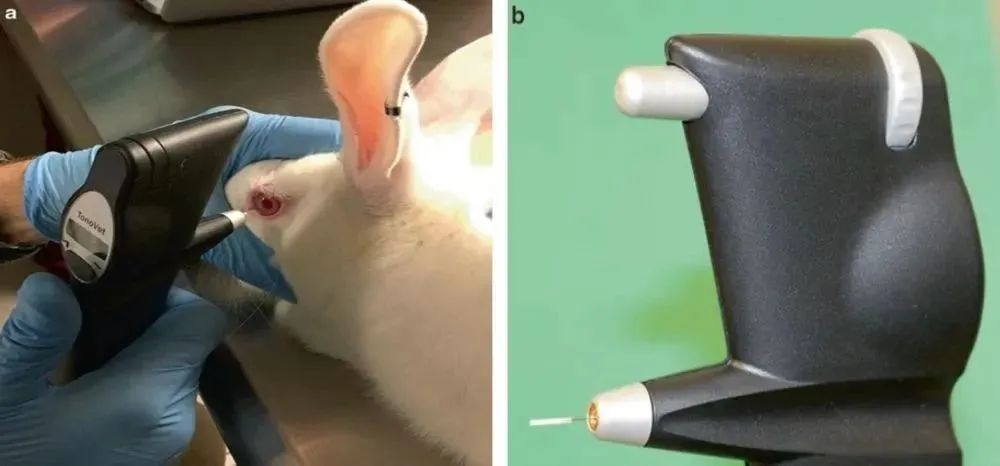
圖2 (a) The Tonovet® 回彈式(shì)眼壓計測量New Zealand white rabbit眼壓 (b) TonoLab 眼壓計小小的尖端可用於齧齒類的眼壓測定
02、角膜厚度測量法
角膜厚度測量法是一種無創性評價角膜厚度的方法。 最常使用專門為此目的設計的接觸式超聲設備(例如 PachPen®)進行(圖3),但也可以通過高分辨率超聲檢查或光學相幹(gàn)斷層掃描(OCT, Optical Coherence Tomography)獲(huò)得角膜厚度的測量結果。在角膜水腫可被生物顯微鏡檢測出之前,角膜厚度測量法可對角膜厚度的細微變化進行評價。角膜厚度可因種屬的不同,以及角膜區域不同(軸向或周邊)而變化。由於區域差異,必須在每個時(shí)間點從角膜的相同區域進行測量,通(tōng)常選用軸向。
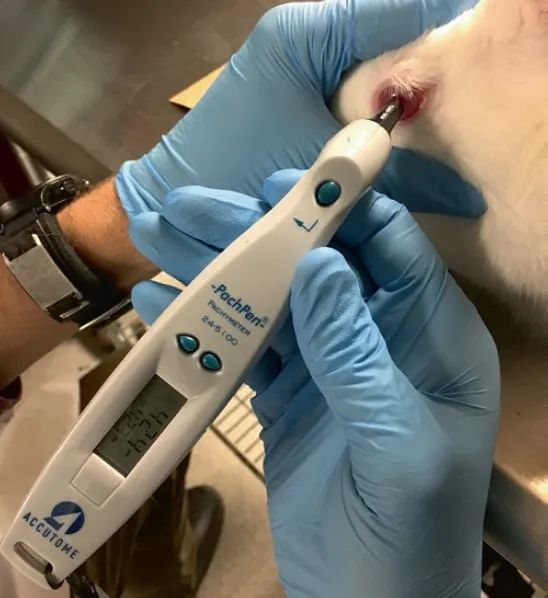
圖3 PachPen 測量New Zealand white rabbit角膜(mó)厚度
03、熒光素染色法
在涉及眼局部給藥、角膜接觸鏡評價的研究,和使用改良 Hackett-McDonald 評(píng)分係統的其(qí)他研究(jiū)中,通常(cháng)使用熒光素鈉溶液評價角膜上皮的完整(zhěng)性。熒光素是一種水溶性熒光染料,可被親水性角膜基質保留,但不被角膜上皮保留。它可用於輔助識別角(jiǎo)膜上皮缺損,也可用(yòng)於評價角膜前的淚膜滯留。熒光素以(yǐ)單個浸(jìn)漬條帶的形式提供,使用時使用無菌生(shēng)理鹽水潤濕。將濕潤的條帶輕輕塗抹在背(bèi)側球結(jié)膜上,注意不要接觸角膜。然後使(shǐ)用鹽水輕輕衝(chōng)洗多(duō)餘的熒光素。或者,可將熒光素條置於塑料注射器中,並加入預定體積的無(wú)菌生(shēng)理鹽水,以產生已知熒光素濃度的溶液,然後滴在角膜上。由眼科檢查人員使(shǐ)用帶有鈷藍濾光片的生物(wù)顯微鏡對(duì)角膜進(jìn)行檢查,觀察是否(fǒu)有殘留的熒光。
04、眼部照(zhào)相
眼部照(zhào)相(xiàng)可用來證明眼(yǎn)底等區域無變化(huà),或(huò)記錄(lù)異常以及監測病變的(de)進展。可在研究(jiū)期間的不同時間點拍攝(shè)照片來進行比較,以準確地確定異(yì)常是靜態的還是進行性的。由於照相增加(jiā)了額外的時間、成本和動物應激,因此並非所有研(yán)究均需進行。在觀察到病變時,或(huò)很可能引起眼部異常的研究中(例如眼內植入物,玻璃體內或視網膜(mó)下注射研究),可在研究方(fāng)案中將其作為一種記錄病變(biàn)的選擇。
眼部照相可(kě)分為眼外部和眼內部。眼外部的拍攝可使用帶有微距透鏡的標準單鏡頭反光(SLR, Single Lens Reflex)數碼相機,或帶屈光度(dù)設置調節以允許眼外部和眼前節成像的數(shù)字 Kowa Genesis-D 眼(yǎn)底照相機。眼後節(jiē)的拍攝需要特定類型的眼底照相機,數字化Kowa Genesis-D 照相(xiàng)機、RetCam、Phoenix Micron IV 和 Micron X 適用於大多數實驗動物的拍(pāi)攝(圖4)。這些照相機可適用於間接眼(yǎn)部照相、齧齒類動物眼底照相和熒光血管造影。眼底照相的優點是能夠永久(jiǔ)保(bǎo)存記錄,以比較潛在的研究相關結果,如果有發現,則可由另一名眼科(kē)檢查再次進行獨立審(shěn)閱。
在拍攝照(zhào)片時,所有照片(piàn)都應使用(yòng)相同的放大倍率(lǜ)和照明設置。此外,所有動物均應按相同眼別順序(左和右)進行(háng)拍攝,同時應保存動物標識和設(shè)備(bèi)日誌(zhì)等(děng)拍攝記錄。上述標準也可作為標(biāo)準操作規程(chéng) (SOP, Standard Operating Procedures) 的一部分。
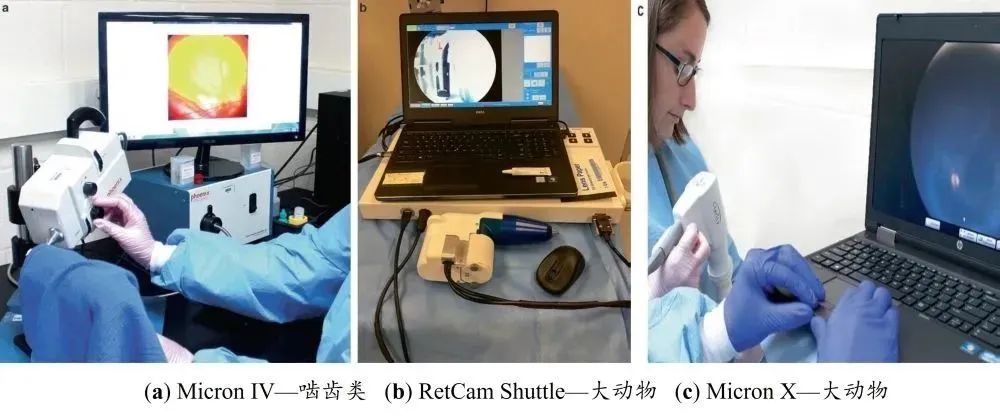
圖4 可用於實驗動物的眼底相機
05、熒光血管造影
熒光血管造(zào)影可用於評價眼內動脈和靜(jìng)脈的血管完整性。雖然其最常(cháng)用於檢查視網膜和脈絡膜的血管,但也可用於檢查虹膜血管。在毒理學研究中最常(cháng)用於評價供(gòng)試品對於新生(shēng)血管形成的影響。目前,它(tā)已被應用於多種實驗動物,最常選(xuǎn)用(yòng)的是10%熒光素鈉,也有部分研究選(xuǎn)擇吲哚菁綠(lǜ)。
熒光血管造影技術需要散瞳,並進行鎮靜或麻醉。將光可激(jī)發的化合物熒光素靜脈注射,可獲得目標組(zǔ)織(zhī)(脈(mò)絡膜視網膜和虹膜)的(de)一係列定時圖像。與熒光(guāng)素注射相關(guān)的並發症可能包(bāo)括滲漏後組織刺激、嘔吐和過敏反應。必須在能夠拍攝(shè)多幅、快速排序圖像的眼底照相機上使用激發濾光片 (490 nm) 和屏障濾光片 (520-520 nm)。Kowa Genesis-Df、RetCam Shuttle、Phoenix Micron X 和 Heidelberg Spectralis cSLO 可用於熒(yíng)光血管造影,且是便攜式的(圖4)。在注射熒光素前,先(xiān)拍攝對照的彩色圖像,然後每 20s 拍(pāi)攝一組,獲得連續圖像。由(yóu)於熒光素填(tián)充脈絡膜視網膜血管,因此描述了血管流動(dòng)的各個階段。它們包括動脈前期、動脈期、動靜脈期(qī)、靜脈期及後期(qī)。熒光血管造影觀察到的異常可能包括血管(guǎn)異常(動(dòng)脈瘤、新生血管形(xíng)成)、熒光受阻、熒(yíng)光素滲漏、低熒光和高熒光(guāng)。
06、視網膜電圖/視覺誘發電位
根據毒(dú)理學研究目的,以(yǐ)及可能受影響的視(shì)覺係(xì)統的特定方麵,有(yǒu)多種電生理學試(shì)驗(yàn)可用於評價視網膜(mó)和視覺通路(lù)。視網膜(mó)電圖 (ERG, Electroretinography) 是測量視網膜在受到光刺(cì)激時產生的電勢。標準 ERG 是一種全視野刺激,可提供關於整個視網膜的信息,是(shì)視網膜色素上(shàng)皮、光感受器和內層視網膜的群體反應。對於局部視網膜評價可選用多焦視網膜電圖 (mfERG, multifocal electroretinogram)。對於黃斑區神經節細胞的評價可選(xuǎn)用圖形倒轉視網膜電圖 (PERG, pattern reversal electroretinogram)。而為了評價從視網(wǎng)膜到視覺皮層的整個(gè)視覺通路,視覺誘發電(diàn)位 (VEP, visual evoked potential) 則是首選技術。在這些試(shì)驗中,全視野 ERG最常用於臨床前毒理(lǐ)學試驗。ERG 提供了一種非侵入性的可重複評估視網膜功能的方法,它可結合間接檢眼鏡和組織病理學來對視網膜結構和功能進行綜合評估。
ERG應在散瞳後按標準流程進行,目前人和犬的(de)ERG有許多可參考的國際指南(nán),可作為試(shì)驗設計的參考。在獲得全視野ERG過程中,如下(xià)條(tiáo)件建議保持一致:房間(jiān)照明情況、暗適應、閃光強度、頻率以(yǐ)及使用的鎮(zhèn)靜或麻醉劑劑量。
07、光學相幹斷層掃描
光學相幹斷層掃描是一種高(gāo)分辨率的無創(chuàng)成像技術,可(kě)提供眼部結構的實時橫斷麵圖像(xiàng),最常用於視網膜和視神經,其(qí)軸向(xiàng)分辨率為 2-10 μm,也可用於眼前節的成像。與許多先進的成像技術一樣(yàng),它需(xū)要鎮靜或麻醉、散瞳和專門的設備。當進行 OCT 成像時,可看到所有的單個視網膜層,並測量其厚度,以便(biàn)隨時間進(jìn)行定量和(hé)多次重複評價(jià)。其可測(cè)量視盤的杯麵積、盤麵積、杯直徑、盤直徑以及邊緣麵積。通過 OCT 對前節進行檢查則可了解角膜、前(qián)房、虹膜和虹膜角(jiǎo)膜角的結構信息,且其無需像超聲生物顯微鏡(jìng) (UBM, ultrasound biomicroscopy) 所(suǒ)需的那樣接觸角膜。它還提供了比 UBM更高的軸向分辨(biàn)率。OCT 在實驗動物(wù)中已應用於多個種屬,其在人類疾病(bìng)動物模型和臨床前試驗中的應用也將越來越多。
隨著技術(shù)的進步,頻域 OCT (SD-OCT, spectral-domain OCT) 使用非機械技術,比傳統 OCT 或時域 OCT (TD-OCT, time-domain OCT) 明顯更快。SD-OCT 同時測量一個光譜中多(duō)個波長的反射光,因此被稱為光譜域(yù)。SD-OCT 比 TD-OCT 快 100 倍,每秒可采集 70,000 + 次 A-scan,其掃描速度和(hé)次數的增加可轉化為更高分辨率。
08、角膜內皮(pí)顯微鏡(jìng)檢查
角膜內皮顯微鏡可對角膜內皮細(xì)胞進行活體非侵入性的成像觀察,可采(cǎi)用接(jiē)觸或非接觸方法進行。一旦可視化,可評價角膜內皮細胞的細胞(bāo)形態,並可定量為每 mm 的細胞數量 。正常角(jiǎo)膜內皮細胞排列規則(zé),呈六(liù)角形。內皮顯微鏡可評價細胞的密度、多形性和(hé)變異情況。由於細胞數量可因動物年齡和角膜區域(yù)的不同而變化,因此須(xū)使用相同年齡的動(dòng)物對這些變量進(jìn)行標準化,並檢查軸向角膜。須對動物進行鎮靜或麻醉,以獲得準確的圖像,並可適用於簡化技術的自動化(huà)係(xì)統。FDA 已經(jīng)設立了關於臨床試驗中角膜內皮顯微鏡(jìng)檢查的指南,這些指南可以(yǐ)作為臨床前研究設計的起點。除角膜內皮顯微鏡外,還可選用體內高分辨率共聚焦顯微鏡 (Heidelberg Retina Tomograph with Rostock Corneal Module) 進(jìn)行(háng)角膜內皮成(chéng)像和分析(圖5)。
圖5 Heidelberg Retina Tomograph (with Rostock Corneal Module)用於角膜內皮(pí)的成(chéng)像和(hé)分析
小結
在本篇文章(zhāng)中,我們總結了在醫(yī)藥行業等(děng)研究場景中的非常規眼科檢查的適當(dāng)方法和技術。這些技術將在眼部(bù)毒(dú)理學領域中越來越普遍,技術人員可在研究過程中根據試驗的設計和(hé)已發現的眼(yǎn)科學變化等關鍵因素,來選用進一步的檢(jiǎn)查辦法。
參考文獻
[1] Gilger B C, Cook C S, Brown M H. Standards for Ocular Toxicology and Inflammation [M]. 2018.


